ヒト試験の流れを6ステップで徹底解説!企画から機能性表示食品の届出まで徹底解説
健康食品やサプリメント、化粧品を開発する際、「この製品の良さを、科学的な根拠をもって伝えたい」と考えるのは当然のことです。その科学的根拠、すなわち「エビデンス」を取得するための重要なプロセスが「ヒト試験」です。
しかし、いざ実施しようとすると、「具体的に何から始めればいいのだろう?」「どのような流れで進むのか?」「費用や期間はどれくらいかかるのか?」「最終的に機能性表示食品の届出までどう繋がるのか?」といった多くの疑問が浮かんでくるのではないでしょうか。
この記事では、そうした疑問にお答えするため、ヒト試験の全体像を6つの明確なステップに分け、企画立案から最終目的である機能性表示食品の届出まで、その流れを一つひとつ丁寧に解説します。
この記事を最後までお読みいただくことで、単なる手順の理解に留まらず、各ステップで何をすべきか、そして製品の価値を最大化するための戦略的なポイントまで把握できるでしょう。
20年以上の実績と経験があるアポプラスステーション株式会社
→ヒト試験について無料でお問い合わせする
ヒト試験の価格や種類については下記記事で詳しく解説しています。
ヒト試験とは?種類や価格・臨床試験との違いについて解説
ヒト試験の流れ一覧(まとめ)
ヒト試験は、一直線に進む単純な作業ではありません。製品の価値を科学的に証明し、最終的なゴールを達成するための、戦略的に組まれた一連のプロジェクトです。各ステップは独立しているのではなく、前のステップの成果が次のステップの土台となる、密接に関連したプロセスになっています。
まずは、これから詳しく解説する6つのステップの全体像を把握しましょう。この流れを頭に入れておくことで、各詳細パートの理解がより深まります。

ステップ1:企画立案
ヒト試験の成否は、この「企画立案」の段階で9割が決まると言っても過言ではありません。このステップの目的は、単に試験を計画することではなく、「お客様が望む最終的なゴールから逆算して、製品の価値を最大限に発揮できる試験を設計すること」にあります。
多くの人が「どんな試験ができるか?」から考え始めがちですが、それでは本末転倒です。パイロット試験等で前データがあれば、そのデータから次の研究のゴールを逆算する事ができます。データが無い場合は論文などを検索し研究のゴールをどこに見据えるかを検討したりします。また機能性表示食品を目指したいのであれば、体脂肪を減らす健康食品の場合、で「体脂肪を減らすのを助ける」と表示したいのであれば、その主張を裏付けるために、体重、体脂肪率、ウエスト周囲径、内臓脂肪(CT) CTなどの変化を測定する試験をデザインを設計する必要があります。
このように、最終的なゴールから逆算して考えることで、以下の重要な要素が自ずと定まっていきます。
- 試験の目的: 何を証明したいのかを明確化します。
- 試験デザイン: プラセボ(偽薬)対照二重盲検比較試験など、科学的根拠として最も信頼性の高い方法を選択します。
- 対象者: 製品のターゲットとなる、適切な年齢、性別、健康状態の人々を選定します。
- 評価項目: 目的を証明するために、何を測定・評価するのかを具体的に決めます。
- 期間と費用: 試験の規模や内容に応じた現実的なスケジュールと予算を策定します。
この企画立案は、単なる技術的な作業ではなく、製品の将来を左右する極めて重要な研究です。ここで専門家(CRO:受託研究機関など)と深く連携し、綿密な計画を立てることが、後のステップすべてを成功に導くための盤石な土台となるのです。
20年以上の実績と経験があるアポプラスステーション株式会社
→ヒト試験について無料でお問い合わせする
ステップ2:試験準備
自分たちが研究のゴールと見据えた結果を得るために、実行可能な具体的な計画へと落とし込むのが「試験準備」のステップです。この段階は、計画の質を検証し、試験全体の信頼性を担保するための最初の関門(クオリティゲート)としての役割を果たします。
プロトコル(試験実施計画書)の作成
まず、企画立案で熟考した内容を、「プロトコル(試験実施計画書)」と呼ばれる一冊の公式文書にまとめ上げます。プロトコルは、試験の目的、背景、対象者の選定基準・除外基準、試験食品の用法・用量、検査スケジュール、評価方法、統計解析計画など、試験に関わるすべての事項を詳細に規定した「マスタープラン」です。
このプロトコルが、試験に関わる医師、スタッフ、そして試験参加者全員の行動規範となります。そのため、誰が読んでも誤解が生じないよう、明確かつ網羅的に記述されている必要があります。質の高いプロトコルは、質の高い企画立案の証であり、円滑な試験実施の生命線です。,SPIRIT2025(標準的なプロトコール項目:介入試 験のための推奨,Standard Protocol Items: Recommendations for Interventional Trials)という最低限必要な34項目が明記されたプロトコールガイドラインもあり、こちらに準拠する形で試験が実施されることが多いです。
倫理審査委員会(IRB/EC)の承認
作成したプロトコルは、倫理審査委員会(IRBまたはEC)に提出し、承認を得なければなりません。倫理審査委員会は、医師や法律の専門家、一般の立場を代表する委員などで構成される独立した組織です。
その主な役割は、以下の2点です。
- 試験参加者の人権と安全の保護: 試験に参加する方々の権利、安全、福祉が最大限に守られているかを審査します。
- 科学的な妥当性の評価: 試験計画が科学的に見て適切であり、意義のある結果を生む可能性があるかを評価します。
いかなるヒト試験も、この倫理審査委員会の承認なしに開始することは良くないとされています。これは、試験参加者を守るための絶対的なルールです。
この審査プロセスは、計画の弱点を事前に洗い出す重要なリスク管理の機会でもあります。企画段階でしっかりと練られた計画に基づき、質の高いプロトコルを作成することが、審査をスムーズに通過し、結果的に時間とコストの節約に繋がる鍵となります。
ステップ3:試験実施
倫理審査委員会の承認を得て、いよいよ計画を実行に移すのが「試験実施」のステップです。この段階では、計画通りに試験を進める「ロジスティクスの精度」と、試験参加者の状態をきめ細かく管理する「ヒューマンマネジメント」の二つが、最終的なデータの品質を大きく左右します。
H3最適な医療機関の選定と試験参加者管理
まず、試験の成功に不可欠な、経験豊富な医療機関と医師を選定します。次に、プロトコルで定められた基準(年齢、性別、健康状態など)に合致する試験参加者を募集し、選定します。試験参加者には試験の目的や内容、リスクなどを十分に説明し、自由意思による同意(インフォームド・コンセント)を得た上で参加してもらいます。
H3進捗モニタリングと品質の担保
試験が開始されると、試験参加者が試験食品を正しく摂取しているか、日々の体調に変化はないかなど、進捗状況を徹底的にモニタリングします。
近年では、「WEB生活日誌」のような電子ツールを活用し、試験参加者の健康状態や試験品の摂取状況をリアルタイムで管理することが可能になっています。これにより、何か問題が発生した場合でも迅速に対応でき、試験参加者の安全を確保すると同時に、データの信頼性を高めることができます。
例えば、試験参加者が試験品の摂取を忘れてしまった場合、そのデータは解析から除外する必要があるかもしれません。こうした逸脱をリアルタイムで把握し、適切に対処することが、科学的に価値のある、質の高いデータを取得するための鍵となります。この地道で徹底した品質管理こそが、試験全体の信頼性を支えるのです。
20年以上の実績と経験があるアポプラスステーション株式会社
→ヒト試験について無料でお問い合わせする
ステップ4:集計・統計解析
試験実施期間が終了すると、次はその成果である生データを、科学的な「エビデンス」へと昇華させる「集計・統計解析」のステップに入ります。このステップは、製品が持つ価値の物語を、客観的で揺るぎない「科学の言葉(統計学)」で証明する、極めて重要なプロセスです。
まず、試験を通じて収集されたすべてのデータ(血液検査値、アンケート結果、身体測定値など)を一元的に集約します。そして、「データ固定」という作業を行います。これは、解析対象となるデータセットを最終確定させ、以降は一切の変更ができないようにロックをかけることです。これにより、解析の客観性とデータの完全性を保証します。
データが固定されると、医療統計にも長けた統計解析の専門部隊が、プロトコルであらかじめ定められた計画に従って解析を実施します。ここで行われるのは、単なる平均値の比較ではありません。
例えば、製品を摂取したグループとプラセボを摂取したグループの間で見られた差(例:体重の減少幅)が、「統計学的に有意であるか」を検証します。これは、その差が単なる偶然によって生じた可能性が極めて低い(通常は5%未満)ことを数学的に証明する作業です。
この統計解析によって初めて、単なる「観察結果」は、信頼性の高い「科学的根拠(エビデンス)」へと変わります。このステップは、いわば研究開発の現場(Doing Science)と、マーケティングや届出で活用できる確固たる証拠(Having Science)とを繋ぐ、決定的な架け橋なのです。
ステップ5:結果発表
統計解析によって科学的エビデンスが確立されると、その価値ある資産を社会に公表し、製品の信頼性を飛躍的に高める「結果発表」のステップに進みます。この段階は、自社内にとどまっていた研究成果を、客観的な評価に晒すことで、研究内容や結果のデータに対して信憑性を増すことができます。
学術論文・学会での発表
結果発表の最も代表的で権威ある方法は、学術論文の執筆や、専門誌への投稿です。試験の背景、目的、方法、結果、考察を詳細に記述した論文が、専門家による査読を経て学術誌に掲載されることは、その研究の質と信頼性が第三者によって認められたことを意味します。
また、国内外の学会で研究成果を発表することも、研究内容の科学的価値をアピールする絶好の機会です。これにより、研究内容への「権威付け」がなされ、企業の高い研究開発力を示すことができます。
なぜ企業が貴重なデータを公開するのか。それは、この「公開」というプロセス自体が、データに絶大な信頼性を与えるからです。社内の報告書はあくまで「自社の主張」ですが、査読付き論文は極端な言い方になってしまいますが「科学界が認めた事実」として扱われます。
このようにして得られた公的な評価は、製品パンフレットやウェブサイトでの情報発信においても、大きな安心感と説得力を与える強力な武器となります。結果発表は、単なる報告ではなく、研究資産を社会的な信頼へと転換させるための、重要な活動なのです。
20年以上の実績と経験があるアポプラスステーション株式会社
→ヒト試験について無料でお問い合わせする
ステップ6:機能性表示食品届出
ヒト試験のプロセスを経て、ついに最終ゴールである「機能性表示食品の届出」へとたどり着きます。これは、積み上げてきた科学的エビデンスを基に、製品パッケージに「おなかの調子を整えると報告されています」「脂肪の吸収をおだやかにすることが報告されています」といった具体的な機能性を表示するための、行政への届出手続きです。
科学的根拠の準備:研究レビュー(SR)か臨床試験(RCT)か
機能性を表示するためには、「質の高い科学的根拠」が必須です。その根拠を示す方法には、主に二つの選択肢があります。
- 研究レビュー(SR: Systematic Review):
表示したい機能性について、世界中の既存の学術論文を網羅的に収集・評価し、その結果を統合して科学的根拠とする手法です。自社製品の関与成分に関する質の高い研究がすでにある場合に有効な選択肢となります。 - 臨床試験(RCT: Randomized Controlled Trial):
最終製品そのものを用いて、新たにヒト試験(臨床試験)を実施し、有効性を直接証明する手法です。新規性の高い成分や、既存の研究ではエビデンスが不十分な場合に必要となります。本記事で解説してきた流れは、主にこのRCTを実施する場合に該当します。
どちらの手法を選択するかは、コスト、期間、表示したい内容の確実性などを考慮して判断する、非常に重要な戦略的決定です。
届出に必要な主要書類
機能性表示食品の届出は、消費者庁が定める様式に従い、多岐にわたる書類を作成・提出する必要があります。このプロセスは複雑ですが、専門家の支援を受けながら進めることが一般的です。
以下に、届出に必要となる主要な書類(2025年4月1日時点)の概要を示します。
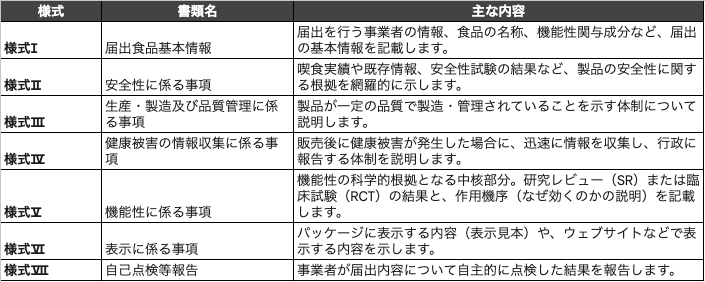
届出における最重要注意点:事業者の最終責任
ここで、最も強調しておきたい重要な点があります。CROのような専門家は、これらの複雑な書類作成を強力にサポートしてくれますが、届出内容に関する最終的な責任は、すべて製品を販売する事業者(届出者)自身にあるということです。
これは、「専門家に任せきりにしない」ということを意味します。提出する書類の内容は、自社の責任において十分に理解し、確認・承認することが不可欠です。機能性表示食品という表示は、消費者に対する公的な約束です。その約束を果たすための責任は、届出を行った事業者が未来永続的に負うことになります。
届出が受理されることはゴールではなく、消費者への責任を果たす新たなスタート地点であると認識することが、事業を継続していく上で極めて重要です。
まとめ
本記事では、ヒト試験の全体像を、企画立案から機能性表示食品の届出に至るまでの6つのステップに沿って詳しく解説してきました。
- 企画立案: ゴールから逆算して試験を設計する、最も重要な戦略フェーズ。
- 試験準備: 計画をプロトコルに落とし込み、倫理審査で承認を得る品質保証フェーズ。
- 試験実施: 計画に基づき、データの品質と試験参加者の安全を徹底管理する実行フェーズ。
- 集計・統計解析: 生データを科学的エビデンスへと昇華させる証明フェーズ。
- 結果発表: エビデンスを公表し、製品と企業の信頼性を構築する権威付けフェーズ。
- 機能性表示食品届出: エビデンスを基に、消費者への約束である機能性表示を実現する最終フェーズ。
ご覧いただいたように、ヒト試験は単なる科学実験ではありません。それは、製品の信頼性を築き、市場での明確な差別化を図り、そして何よりも消費者との間に揺るぎない信頼関係を構築するための、本質的な「投資」です。
この複雑で専門的なプロセスを成功に導くためには、経験豊富な専門家とのパートナーシップが不可欠です。もし、あなたが自社製品の価値を最大限に引き出すためにヒト試験を検討しているのであれば、まずは専門家へ相談し、あなたの取り扱う商品の研究ゴールに合わせた最適な戦略プランを立てることから始めてみてはいかがでしょうか。
20年以上の実績と経験があるアポプラスステーション株式会社
→ヒト試験について無料でお問い合わせする




