目や鼻の不快感のヒト試験とは?分かりやすく徹底解説
近年、食品やサプリメントの分野において、「目や鼻の不快感」に関連する機能性を訴求する製品開発への関心が高まっています。これらは特に、花粉やハウスダストの、環境要因等による一時的な不快感を対象としたものが含まれるようです。
こうした機能性について科学的な根拠を示すため、ヒトを対象とした試験(ヒト試験・臨床試験)の実施が求められるケースがあります。製品の研究開発やマーケティングを担当する企業担当者にとって、こうした試験がどのように計画され、実施されるのかを理解することは、事業推進上の重要な検討事項となり得ます。
本記事では、企業担当者の方を対象に、「目や鼻の不快感」を評価するヒト試験に焦点を当てます。その目的、一般的な試験デザイン、用いられる評価指標、そして実施にあたっての倫理的・実務的なプロセスについて概説します。
ヒト試験における「目や鼻の不快感」の扱いと目的
ヒト試験を計画する際、まず重要になるのが「誰を対象に」「何を評価するか」を明確に定義することです。
食品やサプリメントの機能性を評価するために行われる試験では、「健康な成人」のうち、「日常生活において目や鼻の不快感の自覚症状がある」ものの、「薬物治療の必要はない」方々、といった形で設定される例が見られます。これは、疾病の治療を目的とするのではなく、あくまで健康な状態の範囲内での不快感の緩和・軽減を評価するためとなります。。
この試験において評価対象となる「不快感」とは、具体的な症状として「くしゃみ、鼻水、鼻づまり、目のかゆみなど」が挙げられることが多いようです。試験の目的は、特定の介入(試験食品の摂取など)が、これらの自覚的な不快感に対してどのような影響を与えるかを検証することにあります。
この対象者(健康者か患者か)の選定は、試験全体の設計や、最終的に得られるデータの解釈、さらには表示できる機能性の範囲にも直結する、根本的な計画事項と言えるでしょう。
試験計画の設計(デザイン):信頼性の高いデータの収集
「目や鼻の不快感」は、個人の感覚に左右されやすい主観的な側面を強く持ちます。そのため、試験で得られるデータの信頼性・客観性を高めるためには、厳格な試験デザイン(試験計画の設計)が不可欠とされます。
ランダム化比較試験(RCT)の採用
科学的根拠の質において、特に信頼性が高いと見なされる試験デザインの一つが「ランダム化比較試験(RCT: Randomized Controlled Trial)」です。この分野の研究においても、「ランダム化プラセボ対照二重盲検並行群間比較試験」といった設計が採用されることが多々報告されています。
このデザインは、いくつかの重要な要素で構成されています。
- ランダム化(Randomized): 試験参加者を、試験食品(や介入)を受けるグループと、そうでないグループ(対照群)とに、無作為(ランダム)に割り付けます。これにより、グループ間に生じ得る偏り(バイアス)を最小限に抑えることが期待されます。
- プラセボ対照(Placebo-Controlled): 対照群には、「プラセボ」が用いられます。プラセボとは、外見や味、匂いなどは試験食品と区別がつきませんが、評価対象となる機能性関与成分を含まないものです。不快感のような主観的な指標は、「何かを摂取している」という意識だけで改善したように感じられること(プラセボ効果)があり得るため、プラセボ群との比較は、介入の真の影響を測る上で重要とされます。
- 二重盲検(Double-Blind): 試験参加者本人も、試験を実施する医師やスタッフも、誰が試験食品を摂取し、誰がプラセボを摂取しているのかを知らない状態(盲検化)で試験を進行させます。これにより、評価や報告における無意識の期待や先入観がデータに影響を与えることを防ぎます。
- 並行群間比較(Parallel-Group): 試験食品群とプラセボ群の2つ(またはそれ以上)のグループを設け、試験期間を通じて並行して比較評価します。
こうした厳格なデザインを採用することは、得られたデータが「プラセボ効果」や「実施者の期待」といった交絡要因によるものではなく、介入そのものによる可能性が高いことを科学的に示すために必要とされています。
試験対象者の選定基準(適格性)
試験デザインと並び、どのような人物を試験に参加してもらうかを定義する「適格性基準」も、データの質を左右します。
- 選択基準(Inclusion Criteria): 試験の目的に合致する対象者を集めるための基準です。例として、「20歳以上65歳未満の健康な日本人男女」といった年齢や健康状態の定義や、「目や鼻の不快感の自覚症状がある」といった症状の有無が設定されます。
- 除外基準(Exclusion Criteria): 試験結果の解釈を困難にする要因や、安全性の観点で問題を生じる可能性がある人々を、あらかじめ対象から除外するための基準です。例えば、評価対象の症状に影響を与える可能性のある医薬品を日常的に使用している人、関連する他の疾患(慢性的な呼吸器疾患など)を持つ人、試験食品の原材料にアレルギーを持つ人などが設定されることが考えられます。
これらの基準を明確に設定し、遵守することで、試験の内的妥当性(試験結果の正しさ)と安全性を高めることができます。
不快感の「評価指標」:どのように測定・数値化するか
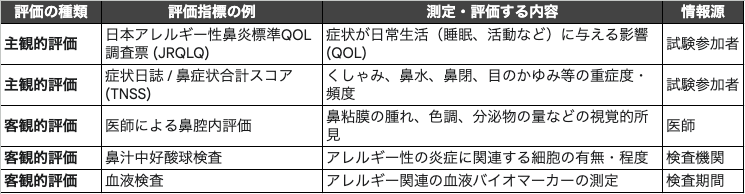
「目や鼻の不快感」という主観的な感覚を、科学的に評価・比較するためには、それを客観的な「評価指標」に置き換える必要があります。信頼性の高い試験では、主観的な評価と客観的な評価を組み合わせて用いることが一般的です。
主観的評価指標:QOL調査票と症状日誌
試験参加者本人の感じ方や日常生活への影響は、このテーマにおける最も重要な評価項目(主要アウトカム)の一つとして設定されることが多いようです。
- QOL (Quality of Life) 調査票:
症状がどの程度、日常生活の質(QOL)に影響を与えているかを数値化するために、検証済みの標準的な調査票が用いられることがあります。代表的なものに「日本アレルギー性鼻炎標準QOL調査票(JRQLQ)」があり、実際の試験でも主要な評価項目として採用された例が報告されています。こうした標準化された調査票は、結果の信頼性や比較可能性を高めるとされています。 - 症状日誌(ダイアリー)と症状スコア:
試験参加者に、日々の特定の症状(例:くしゃみ、鼻水、鼻づまり、目のかゆみ)の程度(重症度)や頻度を日誌に記録してもらう方法です。これらの個々の症状スコアを集計し、例えば「鼻症状合計スコア(TNSS: Total Nasal Symptom Score)」として総合的に評価することもあります。
客観的評価指標:医師の所見とバイオマーカー
主観的な評価を補強し、身体的な変化(所見)を捉えるために、客観的な指標も重視されます。これらは副次的な評価項目(副次アウトカム)として設定されることが多いです。
- 医師による鼻腔内の評価:
医師が、試験参加者の鼻腔内を視覚的に評価します。具体的な評価項目として、「下鼻甲介粘膜の膨張(腫れ)」「下鼻甲介粘膜の色調」「水様性分泌量(鼻水の量)」などが挙げられ、これらをスコア化して記録する手法が取られることがあります。 - 臨床検査(バイオマーカー):
体液や組織を分析し、生物学的な変化を捉える方法です。例えば「鼻汁検査(鼻汁好酸球検査)」は、アレルギー性の炎症反応と関連があるとされる好酸球という細胞が鼻汁中にどの程度存在するかを顕微鏡で観察する検査です。細菌やウイルス感染では主に好中球が増加するのに対し、アレルギー性の反応では好酸球の増多が見られることがあり、客観的な所見の一つとされます。
さらに、より先端的な研究レベルでは、アレルギー性鼻炎の病態に関連する特定の免疫関連遺伝子(CST1, CST2など)をバイオマーカーとして特定しようとする試みも報告されています。
試験計画時には、これらの指標群(下表参照)から、何を「主要アウトカム(最も重視する結果)」とし、何を「副次アウトカム(補足的な結果)」とするかを明確に定義する必要があります。一般的に、QOL調査票や症状スコアといった主観的指標が主要アウトカムに設定され、医師の所見や検査値といった客観的指標が副次アウトカムとして、主観的評価の妥当性を裏付けるために用いられる構成が見られます。
表:目や鼻の不快感に関するヒト試験で用いられる評価指標の例
試験実施を支える倫理的・科学的基盤
ヒトを対象とする研究は、参加者の人権と安全性を最優先に守りつつ、科学的に信頼できるデータを取得することが絶対的な前提となります。そのために、国際的な基準や国内の法律・指針に基づいた厳格なルールが定められています。
人を対象とする研究の倫理指針
日本では、厚生労働省や文部科学省などが定める「人を対象とする生命科学・医学系研究に関する倫理指針」といったガイドラインが存在します。すべてのヒト試験は、これらの指針を遵守して計画・実施される必要があります。
これらの指針の中核をなすのが、「倫理審査委員会(IRB: Institutional Review Board)」または「独立倫理委員会(IEC: Independent Ethics Committee)」による審査です。研究計画書、試験参加者への説明文書、同意書、募集広告の案など、試験に関連するすべての資料は、研究を開始する前にIRB(またはIEC)に提出され、倫理的・科学的な妥当性について厳密な審査を受け、承認を得なければなりません。IRBは、試験参加者の人権、安全、福祉が保護されているかを独立した立場で監視する役割を担います。
インフォームド・コンセント(IC)の手続き
インフォームード・コンセント(IC)は、単に同意書に署名をもらうことではありません。研究者は、試験参加者となる可能性のある方に対し、試験の目的、方法、期待される利益、予測されるリスクや不利益、試験への参加が任意であること、いつでも同意を撤回できることなどを、文書を用いて十分に説明する必要があります。
試験参加者は、それらの情報を理解・納得した上で、自らの自由意志によって参加を決定します。このプロセス全体の透明性と自発性の確保が、倫理的な試験実施の根幹とされています。
データ信頼性の担保:モニタリング
食品の試験においても試験依頼者(企業など)は「モニタリング」を実施することが求められる場合があります。モニターと呼ばれる担当者が、試験が研究計画書やGCP、関連指針を遵守して行われているか、医療機関で記録された原資料(カルテ、検査データなど)と、収集された症例報告書のデータが正確に一致しているか(SDV: Source Data Verification)などを定期的に確認・検証します。
こうした倫理指針やGCP等に基づくプロセスは、一見すると煩雑に見えるかもしれません。しかし、これらは試験参加者を保護すると同時に、取得したデータが科学的・社会的な(例えば、機能性表示食品の届出資料としての)信頼に足るものであることを保証するために、不可欠な手順と言えます。
計画から実施までの実務的プロセスと留意点
実際に「目や鼻の不快感」に関するヒト試験を企業が計画・実施する上では、いくつかの実務的な課題や留意点が存在します。
実施時期と環境の選定
花粉による不快感を評価する場合、試験の実施時期は極めて重要な要因となります。スギやヒノキといった特定の花粉の飛散時期(例えば、東京都の過去の平均では2月中旬から4月末頃)に合わせて試験を実施する必要があります。
この「季節性」は、試験実施の大きな制約となります。試験のタイミングが限定されるため、IRBの審査、試験参加者の募集、資材の準備などを、花粉飛散シーズンより何ヶ月も前から逆算して計画的に進めなければなりません。
この季節性や天候による花粉飛散量の変動といった課題を克服し、より均質で再現性の高いデータを取得する方法として、「環境暴露チャンバー(OHIO Chamberなど)」と呼ばれる特殊な施設を利用するアプローチも報告されています。これは、人工的に管理された室内空間で、一定濃度の花粉などのアレルゲンを暴露させ、症状の変化を評価する手法です。これにより、季節に関わらず、標準化された条件下での試験実施が可能になるとされています。
試験参加者の募集における配慮
試験への参加者を募るための広告(ウェブサイト、ポスター、ソーシャルメディアなど)は、試験実施計画の一部と見なされます。
そのため、募集に用いるすべての資材は、事前にIRB(倫理審査委員会)の審査と承認を受ける必要があります。広告の内容には厳格なガイドラインがあり、試験参加を過度に促すような表現や、利益を強調しすぎる内容は避けなければなりません。また、医薬品の治験などでは、治験薬の名称や記号を表示しないなど、広告該当性に関する特定のルールが設けられている場合があります。
外部専門機関(CRO)の活用
ヒト試験の実施には、前述したような倫理指針やGCPに関する深い専門知識、統計解析の技術、医療機関との連携、品質管理体制など、多岐にわたる高度な専門性が要求されます。
多くの食品・サプリメント関連企業にとって、これらの専門機能をすべて自社で賄うことは現実的ではない場合があります。そのため、試験の計画から運営、データ解析、報告書作成(場合によっては論文執筆代行)までを専門的に支援する「CRO(Contract Research Organization:臨床試験支援機関)」といった外部機関を活用することが、一般的な選択肢となっています。
CROは、目や鼻の不快感を対象とした試験や、「機能性表示向けプラン」といった、企業のニーズに合わせた形でサービスや価格例を提示している場合があります。試験実施を検討する企業担当者にとっては、こうした専門機関と協議し、自社の目的(どのようなデータを取得したいか)と、CROの提供するサービス(どのような試験デザイン、評価指標、品質管理が可能か)をすり合わせることが、プロジェクト成功の鍵となります。
まとめ:ヒト試験の実施に向けた社内検討
本記事では、「目や鼻の不快感」を評価するヒト試験について、その計画、評価指標、倫理的・実務的な側面を概説しました。
信頼性の高い科学的根拠を得るためには、以下の3つの柱が重要であると整理できます。
- 強固な科学的デザイン: 試験結果の客観性を担保するため、ランダム化プラセボ対照二重盲検試験(RCT)といった厳格な試験デザインが求められること。
- 検証済みの評価指標: 「不快感」を測定するため、JRQLQのような標準化されたQOL調査票や症状日誌といった主観的指標と、医師の所見や鼻汁中好酸球検査などの客観的指標を組み合わせることが望ましいこと。
- 倫理と品質の保証: 試験参加者の安全と人権を守るための倫理指針とIRBの承認、そしてデータの信頼性を担保するGCPの原則に準拠することが不可欠であること。
これらの要件を満たす試験を自社で企画・推進することは、多くの企業担当者にとって複雑な課題に感じられるかもしれません。試験実施の検討を始めるにあたっては、まず社内で以下の点を整理することが推奨されます。
- 自社が科学的に示したい内容は何か(例:「花粉による一時的な鼻の不快感」など、具体的な範囲は)。
- 対象者は誰か(健康な成人か、特定の条件を持つ人か)。
- 試験実施に必要な専門知識、体制、品質管理システムは社内にあるか。
- 外部の専門機関(CRO)の活用をどの範囲で検討するか。
- 試験実施の時期(季節性)や環境(暴露チャンバーの利用など)を含め、中長期的な予算とスケジュールは確保可能か。
これらの論点を明確にすることが、客観的な根拠に基づく製品開発の第一歩となると考えられます。




